


Experimenten die door kinderen van 8 tot 12 jaar kunnen worden uitgevoerd (vervolg)
![]()
Koud licht
Benodigde chemicaliŽn:
-
natrium hydroxide (gootsteenontstopper)
-
kalium hexacyanoferraat(III), ook wel rood bloedloogzout genoemd
-
waterstofperoxide (3% H2O2 gewicht)
-
luminol
Minimale leeftijd: 12
![]() Doe in
reageerbuis A een mespuntje natrium hydroxide. Voeg een paar ml water toe en los
het natriumhydroxide op.
Doe in
reageerbuis A een mespuntje natrium hydroxide. Voeg een paar ml water toe en los
het natriumhydroxide op.
![]() Doe in
reageerbuis B een klein mespuntje luminol. Voeg geen water toe.
Doe in
reageerbuis B een klein mespuntje luminol. Voeg geen water toe.
![]() Doe in
reageerbuis C een mespuntje kalium hexacyanoferraat(III). Voeg een beetje
waterstofperoxide (3%) toe. Los vervolgens de roodbruine vaste stof op door de
reageerbuis heen en weer te zwenken. De oplossing wordt geel, niet rood!
Doe in
reageerbuis C een mespuntje kalium hexacyanoferraat(III). Voeg een beetje
waterstofperoxide (3%) toe. Los vervolgens de roodbruine vaste stof op door de
reageerbuis heen en weer te zwenken. De oplossing wordt geel, niet rood!
![]() Schenk de oplossing van reageerbuis A in reageerbuis B en
zwenk nu even tot alle vaste stof is opgelost. De oplossing die je krijgt is
kleurloos tot licht geelgroen.
Schenk de oplossing van reageerbuis A in reageerbuis B en
zwenk nu even tot alle vaste stof is opgelost. De oplossing die je krijgt is
kleurloos tot licht geelgroen.
![]() Ga nu
naar een matig verlichte kamer en schenk de oplossing van reageerbuis C bij de
oplossing in reageerbuis B. Het resultaat is een kortstondig prachtig blauw
oplichten. Het licht is best wel fel, maar het houdt niet lang aan. De oplossing
begint ook enigszins te bruisen.
Ga nu
naar een matig verlichte kamer en schenk de oplossing van reageerbuis C bij de
oplossing in reageerbuis B. Het resultaat is een kortstondig prachtig blauw
oplichten. Het licht is best wel fel, maar het houdt niet lang aan. De oplossing
begint ook enigszins te bruisen.
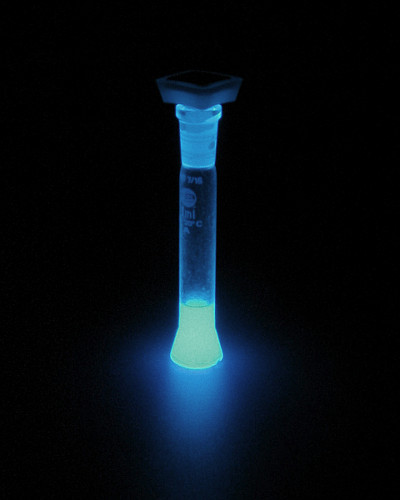
Deze proef is echt heel bijzonder. Bij deze reactie wordt energie uit een chemische reactie vrijwel volledig omgezet in licht en vrijwel geen warmte. Daarom wordt dit ook wel koud licht genoemd, dit in tegenstelling tot licht van vuur.
![]() Let
bij deze proef wel op met natriumhydroxide of oplossingen daar van. Deze stof is
erg corrosief en als het in contact komt met de huid, dan onmiddelijk met water
afspoelen tot het zepige gevoel is verdwenen. Deze stof mag onder geen beding
in de ogen komen, dus gebruik een veiligheidsbril.
Let
bij deze proef wel op met natriumhydroxide of oplossingen daar van. Deze stof is
erg corrosief en als het in contact komt met de huid, dan onmiddelijk met water
afspoelen tot het zepige gevoel is verdwenen. Deze stof mag onder geen beding
in de ogen komen, dus gebruik een veiligheidsbril.
De overige stoffen in het experiment zijn niet bijzonder gevaarlijk, je moet alleen oppassen dat ze niet in de ogen komen.
![]()
Chemische kameleon
Benodigde chemicaliŽn:
-
kalium permanganaat
-
gewone kristalsuiker of een suikerklontje
-
natrium hydroxide
Minimale leeftijd: 12
![]() Doe een heel klein beetje kalium permanganaat in een
reageerbuis en doe daar wat water bij. Zwenk de reageerbuis heen en weer tot de
vaste stof is opgelost. Je moet echt maar heel weinig kalium permanganaat
gebruiken, want de oplossing moet niet zo donker worden dat hij bijna zwart
lijkt. De oplossing in de reageerbuis moet een diep paarse kleur hebben. Als hij
zo donker is dat je er niet meer doorheen kunt kijken dan verdunnen met wat
water.
Doe een heel klein beetje kalium permanganaat in een
reageerbuis en doe daar wat water bij. Zwenk de reageerbuis heen en weer tot de
vaste stof is opgelost. Je moet echt maar heel weinig kalium permanganaat
gebruiken, want de oplossing moet niet zo donker worden dat hij bijna zwart
lijkt. De oplossing in de reageerbuis moet een diep paarse kleur hebben. Als hij
zo donker is dat je er niet meer doorheen kunt kijken dan verdunnen met wat
water.
![]() Doe een
flinke mespunt natriumhydroxide in een erlenmeyer en doe er vervolgens een
theelepel suiker of een suikerklontje bij. Voeg dan 100 ml koud water toe. Zwenk
de erlenmeyer heen en weer tot alle suiker en de natriumhydroxide is opgelost.
Je moet een heldere kleurloze vloeistof hebben.
Doe een
flinke mespunt natriumhydroxide in een erlenmeyer en doe er vervolgens een
theelepel suiker of een suikerklontje bij. Voeg dan 100 ml koud water toe. Zwenk
de erlenmeyer heen en weer tot alle suiker en de natriumhydroxide is opgelost.
Je moet een heldere kleurloze vloeistof hebben.
![]() Schenk de inhoud van de reageerbuis bij de oplossing in de
erlenmeyer en roer met een plastic lepeltje of glasstaafje zodat de oplossing
mooi homogeen paars wordt zoals in de volgende foto is aangegeven:
Schenk de inhoud van de reageerbuis bij de oplossing in de
erlenmeyer en roer met een plastic lepeltje of glasstaafje zodat de oplossing
mooi homogeen paars wordt zoals in de volgende foto is aangegeven:

![]() Wacht nu
en kijk naar de oplossing in de erlenmeyer. Deze verandert langzaam van kleur en
doorloopt de serie, zoals hieronder in het klein is aangegeven.
Wacht nu
en kijk naar de oplossing in de erlenmeyer. Deze verandert langzaam van kleur en
doorloopt de serie, zoals hieronder in het klein is aangegeven.












![]() Het is
leuk om deze proef te herhalen met heet in plaats van koud water, terwijl de
rest gelijk gehouden wordt. Met heet water verloopt de verkleuring veel sneller.
Als je water gebruikt dat eerst helemaal koud is gemaakt met bijv. ijsklontjes,
dan zal de reactie juist langzamer verlopen. Bij hogere temperatuur verlopen
reacties sneller, bij lagere temperatuur verlopen reacties langzamer.
Het is
leuk om deze proef te herhalen met heet in plaats van koud water, terwijl de
rest gelijk gehouden wordt. Met heet water verloopt de verkleuring veel sneller.
Als je water gebruikt dat eerst helemaal koud is gemaakt met bijv. ijsklontjes,
dan zal de reactie juist langzamer verlopen. Bij hogere temperatuur verlopen
reacties sneller, bij lagere temperatuur verlopen reacties langzamer.
![]() Wat je ook kunt proberen is de proef herhalen met twee
theelepels suiker of twee suikerklontjes terwijl de rest het zelfde blijft. Ook
dan zal de reactie sneller verlopen. Hogere concentratie van stoffen doet
reacties sneller verlopen.
Wat je ook kunt proberen is de proef herhalen met twee
theelepels suiker of twee suikerklontjes terwijl de rest het zelfde blijft. Ook
dan zal de reactie sneller verlopen. Hogere concentratie van stoffen doet
reacties sneller verlopen.
Pas op met kaliumpermanganaat, het geeft bruine vlekken in kleding en op de huid. Mocht je per ongeluk zulke vlekken op de huid krijgen, dan kun je die veilig weg halen door de huid te behandelen met een oplossing van een mespuntje kalium metabisulfiet of natrium metabisulfiet in azijn. Als je zulke vlekken in kleding krijgt, dan werkt het bovengenoemd mengseltje ook wel, maar er bestaat kans dat dit mengsel ook blekend werkt op de kleur van de kleding.
![]() Let
bij deze proef wel op met natriumhydroxide of oplossingen daar van. Deze stof is
erg corrosief en als het in contact komt met de huid, dan onmiddelijk met water
afspoelen tot het zepige gevoel is verdwenen. Deze stof mag onder geen beding
in de ogen komen, dus gebruik een veiligheidsbril.
Let
bij deze proef wel op met natriumhydroxide of oplossingen daar van. Deze stof is
erg corrosief en als het in contact komt met de huid, dan onmiddelijk met water
afspoelen tot het zepige gevoel is verdwenen. Deze stof mag onder geen beding
in de ogen komen, dus gebruik een veiligheidsbril.
![]()
Temperatuur sensor
Benodigde chemicaliŽn:
-
cobalt sulfaat
-
zoutzuur (maximaal 10% HCl gewicht)
Minimale leeftijd: 12 met hulp van begeleider/ouder
![]() Neem een
spatelpuntje cobalt sulfaat en doe dit in een reageerbuisje.
Neem een
spatelpuntje cobalt sulfaat en doe dit in een reageerbuisje.
![]() Schenk
een paar ml. verdund zoutzuur (max. 10% HCl, minimaal 8% HCl) bij het cobalt
sulfaat. In totaal mag er niet meer dan 3 tot 4 cm zoutzuur in de reageerbuis
staan, gemeten vanaf de ronde onderkant van de reageerbuis.
Schenk
een paar ml. verdund zoutzuur (max. 10% HCl, minimaal 8% HCl) bij het cobalt
sulfaat. In totaal mag er niet meer dan 3 tot 4 cm zoutzuur in de reageerbuis
staan, gemeten vanaf de ronde onderkant van de reageerbuis.
![]() Zwenk de reageerbuis tot het cobalt sulfaat is opgelost. De
oplossing zal een mooie roze kleur krijgen.
Zwenk de reageerbuis tot het cobalt sulfaat is opgelost. De
oplossing zal een mooie roze kleur krijgen.
De 'temperatuursensor' is nu klaar. De kleur van deze oplossing is afhankelijk van de temperatuur. Als de oplossing kokend heet is dan is hij intens blauw, als de oplossing op kamertemperatuur is, dan is hij roze. Bij een graad of 60 zal hij paars zijn en intenser van kleur dan bij 20 graden.
![]() Ga naar
de keuken en verwarm de reageerbuis voorzichtig boven een gasvlam op de laagste
stand van een kookpit. De oplossing wordt geleidelijk aan warm en verkleurt tot
echt een prachtige diepblauwe kleur. Als je hem weer laat afkoelen, dan wordt
hij weer roze. Dat afkoelen kun je versnellen door de reageerbuis even onder de
langzaam stromende kraan te houden en wat heen en weer te zwenken.
Ga naar
de keuken en verwarm de reageerbuis voorzichtig boven een gasvlam op de laagste
stand van een kookpit. De oplossing wordt geleidelijk aan warm en verkleurt tot
echt een prachtige diepblauwe kleur. Als je hem weer laat afkoelen, dan wordt
hij weer roze. Dat afkoelen kun je versnellen door de reageerbuis even onder de
langzaam stromende kraan te houden en wat heen en weer te zwenken.
De fotos hieronder laten de zelfde reageerbuis zien, op de linker foto is hij koud, op de rechter foto is hij heet, bijna tegen koken aan. Deze kleur verandering kan zo vaak uitgevoerd worden als je wilt.


![]() Dit
is een fraai experiment, maar het is wel nodig dat een vloeistof verhit wordt
tot bijna koken. Houd de reageerbuis ALTIJD van je af gericht bij het verwarmen
en 'kwispel' de reageerbuis heen en weer tijdens het verwarmen, zodat de
vloeistof er in echt heen en weer klotst. Nooit de buis stilstaand verwarmen,
want dan kan door kookvertraging ineens de complete inhoud uit de buis worden
geslingerd.
Dit
is een fraai experiment, maar het is wel nodig dat een vloeistof verhit wordt
tot bijna koken. Houd de reageerbuis ALTIJD van je af gericht bij het verwarmen
en 'kwispel' de reageerbuis heen en weer tijdens het verwarmen, zodat de
vloeistof er in echt heen en weer klotst. Nooit de buis stilstaand verwarmen,
want dan kan door kookvertraging ineens de complete inhoud uit de buis worden
geslingerd.
Oefen met koken van vloeistoffen in reageerbuizen met gewoon water en zorg dat je een veiligheidsbril op hebt. Als je veilig in staat bent om wat water aan de kook te krijgen in een reageerbuis zonder dat alles uit de buis wordt geslingerd en zonder hard ploppen of bijna overkoken dan pas mag je dit experiment uitvoeren! De reageerbuis mag niet meer dan ca. 4 cm water bevatten, gemeten vanaf de ronde onderkant van de buis. Met zo weinig water er in kun je gemakkelijker wat harder heen en weer zwenken zonder morsen en kun je de vloeistof flink laten klotsen tijdens het verwarmen.
![]()
Bespreking van de resultaten
Hoewel het voor kinderen moeilijk zal zijn dit deel van de pagina te begrijpen is het toch goed om iets over de wetenschappelijke achtergrond van deze proefjes te zeggen.
![]() In de
eerste reactie met luminol wordt luminol geoxideerd tot een andere stof, waarbij
energie vrij komt. Deze stof komt vrij in een zgn. 'aangeslagen' kwantumtoestand.
Een kwantumtoestand van een molecuul is een bepaalde energietoestand waarin het
molecuul zich bevindt. In een 'aangeslagen' toestand is het energieniveau hoger
dan je normaliter zou verwachten voor het molecuul. Vanuit die 'aangeslagen'
toestand vindt er terugval naar de gewone toestand en het verschil in energie
tussen de 'aangeslagen' toestand en de gewone toestand wordt als een foton (een
lichtdeeltje) uitgezonden. De kleur van het licht wordt bepaald door het
verschil in energie tussen de 'aangeslagen' toestand en de gewone toestand. Hoe
hoger het energieverschil, hoe meer de kleur in de richting van violet langs de
regenboog loopt. Voor luminol is het energieverschil zodanig dat er een blauw
licht wordt uitgezonden.
In de
eerste reactie met luminol wordt luminol geoxideerd tot een andere stof, waarbij
energie vrij komt. Deze stof komt vrij in een zgn. 'aangeslagen' kwantumtoestand.
Een kwantumtoestand van een molecuul is een bepaalde energietoestand waarin het
molecuul zich bevindt. In een 'aangeslagen' toestand is het energieniveau hoger
dan je normaliter zou verwachten voor het molecuul. Vanuit die 'aangeslagen'
toestand vindt er terugval naar de gewone toestand en het verschil in energie
tussen de 'aangeslagen' toestand en de gewone toestand wordt als een foton (een
lichtdeeltje) uitgezonden. De kleur van het licht wordt bepaald door het
verschil in energie tussen de 'aangeslagen' toestand en de gewone toestand. Hoe
hoger het energieverschil, hoe meer de kleur in de richting van violet langs de
regenboog loopt. Voor luminol is het energieverschil zodanig dat er een blauw
licht wordt uitgezonden.
![]() In het
tweede experiment wordt het diep paarse permanganaat ion omgezet via het
groenblauwe manganaat ion naar uiteindelijk bruin mangaandioxide.
In het
tweede experiment wordt het diep paarse permanganaat ion omgezet via het
groenblauwe manganaat ion naar uiteindelijk bruin mangaandioxide.
![]() In het
laatste experiment worden zgn. liganden uitgewisseld. De roze kleur wordt
veroorzaakt door een complex van cobalt-ionen met watermoleculen er om heen. De
blauwe kleur wordt veroorzaakt door een complex van cobalt-ionen met chloride
ionen. Watermoleculen en chloride ionen worden uitgewisseld. In sterk
vereenvoudigde vorm ziet de reactievergelijking er als volgt uit (links van de
pijl het roze water-complex en rechts van de pijl het diepblauwe chloride
complex):
In het
laatste experiment worden zgn. liganden uitgewisseld. De roze kleur wordt
veroorzaakt door een complex van cobalt-ionen met watermoleculen er om heen. De
blauwe kleur wordt veroorzaakt door een complex van cobalt-ionen met chloride
ionen. Watermoleculen en chloride ionen worden uitgewisseld. In sterk
vereenvoudigde vorm ziet de reactievergelijking er als volgt uit (links van de
pijl het roze water-complex en rechts van de pijl het diepblauwe chloride
complex):
Co(H2O)62+ + 4ClĖ ↔ CoCl42- + 6H2O
terug naar hoofdpagina over experimenten (Engels)